
RepliCel Life Sciences Inc (TSXV:RP)
RepliCel是一家多交所创业板和OTCQB上市的再生医药公司,位于加拿大温哥华,专注于开发健康细胞缺失引起的疾病的自体细胞疗法。
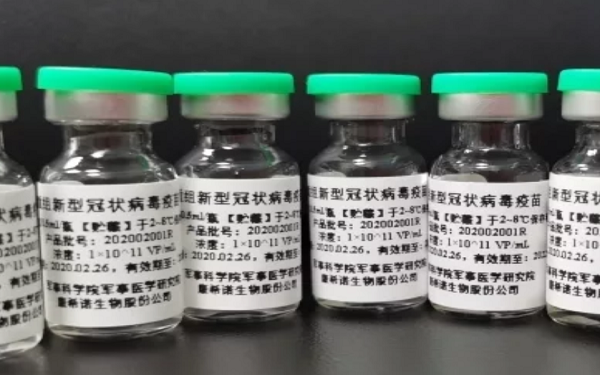
在开发针对新冠病毒疫苗的众多生物制药公司中,迄今为止,中国的康希诺和总部位于马萨诸塞州的Moderna Therapeutics处于领先地位。
康希诺与军事科学院军事医学研究院生物工程研究所联合团队合作研发的重组新型新冠病毒疫苗(腺病毒载体)获得了中国的快速监管批准,开始对其重组新冠病毒疫苗进行人体测试。
康希诺生物董事长兼首席执行官宇学峰博士表示:“新冠疫苗之所以能快速问世并进入临床阶段,不仅依托于我们成熟的腺病毒载体平台技术,更离不开团队自1月下旬以来夜以继日的付出。
康希诺的候选药物被称为Ad5-nCoV,使用其基于腺病毒的病毒载体疫苗平台。2017年,该技术平台曾成功开发我国首个独立研发、具有自主知识产权的创新性重组埃博拉病毒病疫苗,这是2014年西非致命疫情压力之下获得批准的第一批埃博拉疫苗。
新的1期临床试验将在中国武汉18至60岁的健康成年人中进行,这是第一个报告当前SARS-CoV-2病毒病例的研究。根据中国临床试验登记处发布的信息,研究人员计划将108名参与者分为三组,以接受不同剂量的疫苗。
虽然这项研究的主要目的是检查疫苗的安全性,但研究人员还将评估功效指标,包括针对新冠病毒细胞表面的峰值蛋白(这是感染关键)的抗体水平以及针对SARS-CoV-2的中和抗体。
据康希诺称,临床前结果表明该疫苗可在动物模型中诱导强烈的免疫反应,并具有良好的安全性。
同时,由于美国感染人数的增加,FDA已允许在没有动物数据的情况下对Moderna的mRNA疫苗进行1期研究。Moderna表示,美国国立卫生研究院的研究人员确定了第一名受试者。
Moderna候选物mRNA-1273的1期试验将招募45名健康成年人,以三种不同的剂量水平(分别间隔两次和28天)评估注射剂的安全性和免疫原性。
Moderna先前从流行病预防创新联盟(CEPI)获得了资金,以进行一期临床试验。该公司表示,目前正在为可能的二期试验准备材料,该试验可能在几个月后开始。
除康希诺和Moderna外,其他许多公司也在研究新冠病毒疫苗。Inovio在CEPI的900万美元资助下,正在研发一种名为INO-4800的DNA疫苗。该公司计划于4月在美国、中国和韩国开始临床试验。该公司表示,到年底时将能够以现有能力交付一百万份疫苗。
葛兰素史克今年2月向中国的四叶草生物制药公司提供了新冠病毒佐剂。
德国mRNA专家BioNTech已将其疫苗BNT162的中国专利权授予复星医药,并与辉瑞公司在中国以外的市场合作。该候选药物还有望在4月开始临床测试。
英文来源:fiercepharma.com