
RepliCel Life Sciences Inc (TSXV:RP)
RepliCel是一家多交所创业板和OTCQB上市的再生医药公司,位于加拿大温哥华,专注于开发健康细胞缺失引起的疾病的自体细胞疗法。
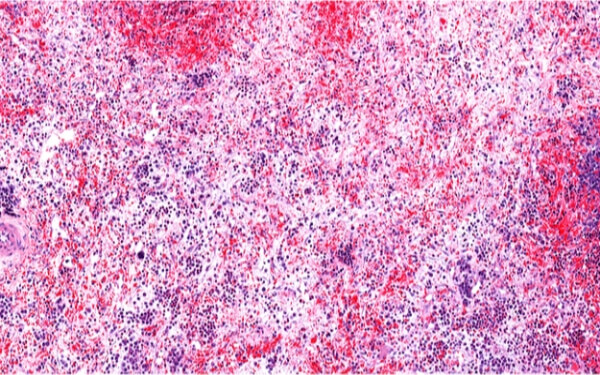
新基制药Celgene(NASDAQ: CELG)周五宣布,美国食品药品监督管理局(FDA)批准生物科技公司Impact Biomedicines的Inrebic(fedratinib)的上市申请,用于治疗中度-2或高风险原发性或继发性(真性红细胞增多症后或原发性血小板增多症后)骨髓纤维化的成人患者。 Inrebic是一种高选择性JAK2激酶抑制剂,也是美国第二款骨髓纤维化治疗药物。2011年,Incyte Corp(NASDAQ: INCY)的Jakafi(ruxolitinib)获批,成为美国首款治疗骨髓纤维化的药物。 Inrebic获批基于的是后期JAKARTA试验的结果,即96名接受fedratinib治疗(每日400毫克)的患者当中,35人的疗效明显。36名患者的骨髓纤维化相关症状减少50%甚至更高。 骨髓纤维化简称髓纤,是一种由于骨髓造血组织中胶原增生,其纤维组织严重地影响造血功能所引起的一种骨髓增生性疾病。造成的结果是,造血功能从骨髓转移至脾和肝,进而导致这些组织的增大。 由于患者在试验中出现韦尼克脑病,赛诺菲Sanofi(NYSE: SNY)无奈放弃了fedratinib的研发。2013年,Impact接手并继续开发。2018年,新基以$70亿的价格收购Impact。Inrebic的标志将包括涉及韦尼克脑病及其他脑病的黑框警告。新基表示,临床试验中接受Inrebic治疗的患者当中,出现严重脑病的比例为1.3%。